理科综合能力测试[化学部分](三)
第Ⅰ卷
(选择题,每小题6分,共48分)
在下列各题的四个选项中,只有一个选项是符合题目要求的。
以下数据可供解题时参考:
原子量: H 1,O 16,Mg 24,Al 27,Fe 56,Cu 64
1.Fe、Mg、Al、Cu四种金属,若两两混合,取26 g混合物与足量的稀H2SO4作用,产生1.12 L H2(标准状况),此混合物可能的组合方式最多有
A.2种 B.3种 C.4种 D.5种
2.下列化学反应的离子方程式能用通式:mM(n+1)++nN=mM+nN(m+1)+表示的是
A.氯化锌溶液中投入钠 B.氯化铁溶液中投入铜
C.硝酸银溶液中投入铜 D.硫酸铜溶液中投入铁
3.某温度下,将2 mol A和3 mol B充入一密闭容器中发生反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡,已知各物质的平衡浓度关系有[A]a·[B]=[C]·[D],若在温度不变的情况下将容器扩大为原来的10倍时,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5 min后达到平衡,已知各物质的平衡浓度关系有[A]a·[B]=[C]·[D],若在温度不变的情况下将容器扩大为原来的10倍时,A的转化率不发生变化,则B的转化率为
A.60% B.40% C.30% D.24%
4.在一定温度下,电解某K2SO4饱和溶液,当阳极产生a mol气体时,溶液析出W g晶体(不含结晶水),则剩余溶液的质量分数为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
5.由甘氨酸(H2N—CH2—COOH)和α—氨基丙酸所组成的混合物在一定条件下可以生成二肽,则二肽的种类有
A.1种 B.2种 C.3种 D.4种
6.下列离子方程式不正确的是
A.向偏铝酸钠溶液中加入过量盐酸 AlO2— + 4H+ = Al3+ + 2H2O
B.MnO2与浓盐酸混合加热 MnO2 + 4H+ +
2Cl—![]() Mn2+ + Cl2↑+ 2H2O
Mn2+ + Cl2↑+ 2H2O
C.等浓度等体积的Ba(OH)2溶液和NaHSO4溶液混合
Ba2+ + OH— + H+ + SO42— = BaSO4↓+ H2O
D.用NaOH溶液吸收少量H2S气体 OH— + H2S = HS— + H2O
7.中草药秦皮中含有的七叶树内酯(![]() )具有抗癌作用。下列关于七叶树内酯的叙述中不正确的是
)具有抗癌作用。下列关于七叶树内酯的叙述中不正确的是
A.能被KMnO4酸性溶液氧化
B.既可以看成酚类化合物又可看成酯类化合物
C.能与银氨溶液发生银镜反应
D.1 mol该物质最多与3 mol Br2 发生反应
8.实验测得常温下0.1 mol·L—1某一元碱(BOH)溶液的pH不等于13,0.1 mol·L—1某一元酸(HA)溶液的![]() ,将两种溶液等体积混合后,所得溶液里各离子的物质的量浓度大小排列正确的是
,将两种溶液等体积混合后,所得溶液里各离子的物质的量浓度大小排列正确的是
A.[A— ]>[B+]>[H+]>[OH— ] B.[B+]>[A— ]>[H+]>[OH— ]
C.[B+]>[A— ]>[H+]=[OH— ] D.[A— ]>[B+]>[OH— ]>[H+]
第Ⅱ卷
(非选择题,共3小题,共50分)
9.(16分)卤代烃R—Cl在一定条件下发生如下反应:
R—Cl
+ KCN![]() R—CN +KCl
R—CN +KCl
R—CN +2H2O + H+ → R—COOH + NH4+
现以乙烯为原料经过下图所示的反应制取有机物W。

已知A、B、C、D、E均为烃的衍生物,请填写:
(1)若甲为Cl2,乙为HCl,生成物W的分子式为C8H14O4,则W的结构简式为
____________________________________。
(2)若甲、乙均为Cl2,C与E在一定条件下以1:1的比例发生反应,生成链状高分子化合物W,则W的结构简式为______________________。
(3)若甲、乙均为HCl,则C与E反应生成W的化学方程式为(有机物用结构简式表示)____________________________________________________________。
(4)若W的分子式为C5H10O3,则甲为______________,乙为_____________。
10.(15分)A、B、C是单质,X、Y、Z、H、J、L是化合物,B在空气中燃烧得到J和少量X。在适当的条件下,它们相互之间有如下图所示的转化关系:
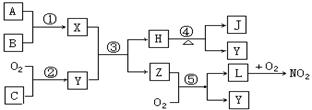
请回答下面问题:
(1)单质A是______,单质C是_______,化合物Z是________(填写化学式)。
(2)反应①③⑤的化学方程式分别为:
反应① __________________________________________
反应③ __________________________________________
反应⑤ __________________________________________
11.(19分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,有关反应方程式为2FeCl3 + Cu = 2FeCl2 + CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102 mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入3.00 mol·L—1AgNO3溶液60.00 mL时,溶液中的Cl—恰好完全沉淀。计算:
(1)溶液A中FeCl3的物质的量浓度为________________;
(2)假设铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于___________;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填写下表相关栏目。
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_________ mol·L—1。
理科综合能力测试(化学部分)参考答案及评分标准
Ⅰ卷 每小题6分,共48分
1.C 2.D 3.B 4.B 5.D 6.D 7.C 8.A
Ⅱ卷 包括3小题,共50分
9.(16分)
(1)CH3CH2OOC-CH2-CH2-COOCH2CH3 (4分)
(2)![]() (4分)
(4分)
(3)CH3CH2COOH
+ HOCH2CH3 ![]() CH3CH2COOCH2CH3
+ H2O (4分)
CH3CH2COOCH2CH3
+ H2O (4分)
(4)HCl,Cl2 (每空2分)
10.(15分)
(1)N2,H2,NH3 (每空2分)
(2)①
3Mg + O2![]() 2MgO (3分)
2MgO (3分)
③ Mg3N2 +6H2O = 3Mg(OH)2↓+ 2NH3↑ (3分)
⑤ 4NH3 + 5 O2![]() 4NO
+ 6H2O (3分)
4NO
+ 6H2O (3分)
11.(19分)
(1)3.00 mol·L—1 (2分) (2)67.2 g (2分)
(3)(每空3分)
| 0<m≤67.2 | 0<n≤76.8 |
| m>67.2 | (m-67.2)<n≤(m+9.6) |
(4)2.50 (3分)