隆昌一中高07级实验班针对训练五
1、下列反应的离子方程式正确的是 ( )
①往硝酸银溶液中滴加少量氨水:Ag++2NH3==Ag(NH3)2+
②将金属钠加入水中:2Na + 2H2O = 2Na+ + 2OH - + H2 ↑
③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+ Ca2++CO2↑+H2O
④氟气与水反应:F2+H2O=H+ +F -+ HFO
⑤小苏打溶液中加入少量的石灰水:Ca2+ +2OH-+2HCO3-=CaCO3↓+CO32- +2H2O
⑥次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO- + CO2 + H2O =CaCO3↓+ 2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na =2Na+ +Cu
⑧氯气与水反应Cl2 + H2O = 2H+ + Cl - + ClO-
⑨纯碱溶液中滴加少量盐酸CO32- + H+ = HCO3-
A.②③⑤⑨ B.①②⑤⑨ C.④⑤⑥⑦ D.②③⑧⑨
2、近年来,科学家发现由100个碳原子构成的一个具有完美对称性的C100原子团,其中每个C原子仍可形成4个化学键。最内是由20个C原子构成的正十二面体,每个C原子与相邻的3个C原子相连;外层的60个C原子形成12个分立的正五边形;处于中间层的C将内外层的所有C连接在一起,当它与氢或氟在适当条件下充分反应时,其形成的分子式应为(已知:多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2 )( )
A、C100H20和C100F20 B、C100H60和C100F60
C、C100H12和C100F12 D、C100H40和C100F40
3、甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是:
。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
。
(3)在一定条件下,甲与O2反应的化学方程式是 。
(4)丁的元素符号是 ,他的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
4、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
_____________ >______________ 。
(2)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式:_____________________________________________________________ 。
(3)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应、且生成气体的离子方程式:_______________________________________________________________。
(4)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池的电极反应方程式:
负极:____________________________; 正极:_____________________________。
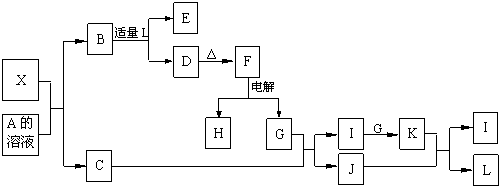 5、1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
5、1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
(1)写出X的化学式:____________,X属于__________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
![]() +2N2
+2N2![]() 4X+SiC+3C。
4X+SiC+3C。
![]() 6、已知:
6、已知:
(1)该反应的生成物中含有的官能团的名称是______,该物质在一定条件下能发生____;
①银镜反应 ②酯化反应 ③还原反应
![]() (2)已知HCHO分子中所有原子都在同一平面内。若要使R1CHO分子中所有原子都在同一平面内,R1可以是_____________(填序号);
(2)已知HCHO分子中所有原子都在同一平面内。若要使R1CHO分子中所有原子都在同一平面内,R1可以是_____________(填序号);
① —CH3
② —
③ —CH=CH2
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
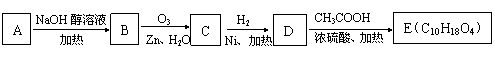
结构分析表明E分子中含有两个甲基且没有支链。试回答:
① 写出C的分子式:_________________;② 反应类型::A→B:_________ C→D:__________
③写出反应方程式:A→B:
D→E______________________________
1、A 2、B
3、(1)CaC2+2H2O→C2H2↑+Ca(OH)2
![]() (2)答案略。(只要考生的答案符合题意要求,即可给分)
(2)答案略。(只要考生的答案符合题意要求,即可给分)
|
(4)
(5)金刚石
4、(1)HClO4>H2SO4 (2)Cl2 + 2NaOH = NaCl + NaClO + H2O
(3)H+ + HSO3— = SO2↑+H2O
(4)2H2 + 4OH— -4e = 4H2O O2 + 2H2O + 4e = 4OH—
5、⑴AlN 原子
⑵AlN+NaOH+H2O==NaAlO2+NH3↑
3NO2+H2O==2HNO3+NO
⑶Al4SiC4
6、(1)醛基 ① ③
(2)② ③
(3)①C6H10O2
![]() ② A:
② A:
E:CH3COO(CH2)6OOCCH3
