高考化学理综精品模拟测试题8+4(一)
可能用到的相对原子质量:H:1 C:12 Na:23 S:32 Cl:35.5 Ca:40 Ti:48
第Ⅰ卷 选择题(6×8=48分)
6、2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不吻合的是( )
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥提高粮食产量
7、实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
![]()
| |
A.2Al+2OH-+2H2O = 2AlO2-+3H2↑
B.2HCO3-+2AlO2-+H2O = 2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O = NH3·H2O+ Al(OH)3↓
D.3H++ Al(OH)3 = Al3++3H2O
8、金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:aTiO2 + bCl2 + cC ![]() aTiCl4 + cCO ……反应I
aTiCl4 + cCO ……反应I
TiCl4 +2Mg ![]() Ti + 2MgCl2
………反应II
Ti + 2MgCl2
………反应II
关于反应①、②的分析不正确的是( )
① TiCl4在反应I中是还原产物,在反应II中是氧化剂;
② C、Mg在反应中均为还原剂,被还原;
③ 在反应I、II中Mg的还原性大于C,C的还原性大于TiCl4;
④ a=1,b=c=2;
⑤ 每生成19.6 g Ti,反应I、II中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
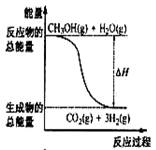 9、甲醇质子交换膜燃料电池(原电池原理是H2与O2反应生成水)中将甲醇蒸气转化为氢气的两种反应原理是:
9、甲醇质子交换膜燃料电池(原电池原理是H2与O2反应生成水)中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2 (g)+3H2(g); △H= + 49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如右图所示
C.该燃料电池中的质子交换膜可以自由透过CH3OH(g)、H2(g) 、O2(g)等气体分子
D.根据②推知:0.5 mol的CH3OH(l)发生反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g),若该反应为放热反应,则放出的热量小于96.45KJ
10、无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
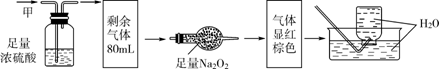
A. NH3、NO2、N2 B. NH3、NO、CO2
C. NH3、NO2、CO2 D. NO、CO2、N2
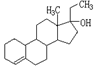 11、实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如下图所示。下列叙述中正确的是( )
11、实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如下图所示。下列叙述中正确的是( )
A.该物质可以视为酚类
B.该物质分子中的所有碳原子均共面
C.能使溴的四氯化碳溶液褪色
D.在浓硫酸作用下,分子内消去一个水分子,产物有两种同分异构体
12、限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合下列的离子方程式2H++SO32—=H2O+SO2↑的化学方程式个数有( )
A、4 B、6 C、8 D、12
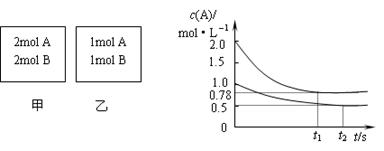 13、向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g)
13、向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g)![]() xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示:
下列说法正确的是( )
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
第Ⅱ卷 非选择题(60分)
26、(17分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B的最外层电子数次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D的最高价氧化物对应水化物名称为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
若反应的溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为
(5)实验室欲检验CD溶液中所含的D—,操作方法和现象为
。
27、(11分)已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B![]() M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
(1)若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为_________________;反应②的离子方程式为_____________________;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为____________________________________________________。
(2) 若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层的2倍,则X在元素周期表中的位置是第______周期______族。X单质的熔点是112.8℃,则X单质的晶体类型属于________晶体。X与碳单质在一定条件下可以生成CX2的化合物,其分子结构类似于CO2,则CX2属于(填“极性”或“非极性”)__________分子。反应②的化学方程式为___________________________________。
28、(18分)A~K分别代表九种不同的有机物。它们之间的相互转化关系如下图:
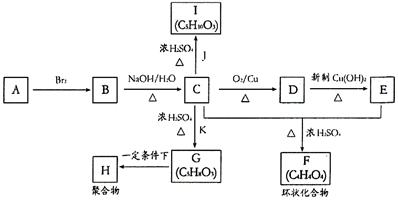
(1)A的结构式为 ;F的结构简式为 ;指出C→G的反应类型 。
(2)写出下列转化的化学方程式
①C→D
②G→H
(3)与有机物Ⅰ互为同分异构体,且结构中含有羧基和羟基的有机物共有 种。
(4)已知标准状况下1.68L气体A在足量氧气中完全燃烧,若将产物通入足量的澄清石灰水,得到白色沉淀的质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
①燃烧产物中水的质量为 g。
②假如气体A是两种等物质的量的气体混合物,其中只有一种是烃,请写出它们可能的分子式(只要求写出一组) 。
29、(14)化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2.1。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol·L-1的H2S溶液的pH约为4.5。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g。
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250mL溶液,测得pH=10.3。
[分析猜想] Na2SO3·7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行 次。
(2)给Na2SO3·7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明。
。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
。实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证。请简单叙述实验步骤、现象和结论。
高考理综化学精品模拟8+4(一)参考答案
6、D 7、B 8、D 9、D 10、B 11、C 12、C 13、D
26、(1)高氯酸(2)![]() ;离子键和非极性共价键 (3)2I-+ ClO-+ H2O = I2
+ Cl-+ 2OH- (4)2Cl-+ 2H2O
;离子键和非极性共价键 (3)2I-+ ClO-+ H2O = I2
+ Cl-+ 2OH- (4)2Cl-+ 2H2O![]() Cl2↑+H2↑+2OH-;0.78g;(5)取适量NaCl溶液置于试管中,向其中滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-。
Cl2↑+H2↑+2OH-;0.78g;(5)取适量NaCl溶液置于试管中,向其中滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-。
27、⑴ NaCl的电子式(略 )Cl2+2OH-=Cl-+ClO-+H2O 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O ⑵三 ⅥA 分子 非极性 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(每个方程式2分,其余各1分,共11分)
28、(18分,方程式3分,其余每空2分)
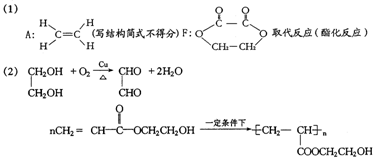
(3)12种(4)①2.7g ②C3H6与CH2O或C4H6与H2或C3H8与CO
29、 (1) 4 (2) 避免Na2SO3被氧化 2Na2SO3+O2=2Na2SO4
(3) 4Na2SO3![]() Na2S+3Na2SO4
Na2S+3Na2SO4
(4) 实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32—,溶液的碱性强
S2- + H2O![]() HS-+OH-
HS-+OH-
(5) 取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42—