中学化学习题汇编《氧 族》基本部分
选 择 题
1.在氯化钡溶液中通入SO2 ,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2 ,结果两试管中都有白色沉淀生成.由此得出下列结论合理的是-----------------------------------------------(C D)
A.氯化钡有两性
B.两支试管中的白色沉淀都是BaSO4
C.SO2 具有还原性和酸性
D.升高PH值使SO2 水溶液中SO3 2- 浓度增大
2.在体积可变的密闭容器中,将等体积的H2 S和SO2 在常温常压下混合,充分反应后,气体体积与反应前气体体积之比为---------------------------------( C )
A.![]() B.
B.![]() C.小于
C.小于![]() D.大于
D.大于![]()
【提示】:过量的SO2 溶于生成的水中
3.将H2S和O2的混和气体,在120℃的温度下,装入密闭容器中,在高温下使之反应。已知全部的H2S和O2都参加了反应,反应后测得压强为反应前的![]() 倍,则原混和气体中H2S和O2的物质的量之比为---------------------------------(A)
倍,则原混和气体中H2S和O2的物质的量之比为---------------------------------(A)
A.1:1 B.1:2 C.2:1 D.3:2
〖提示〗: xH2S+yO2
=![]() S+
S+![]() SO2+xH2O
SO2+xH2O
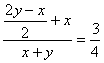
![]() =1
=1
4.a克铜与足量的浓硫酸共热,完全反应产生标况下b升气体,则被还原的硫酸不可能是------------------------------------------------------------------------------(BC)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.密度为1.45克/厘米3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为------(D)
A.29.6% B.42.1% C.14.8摩/升 D.6.22摩/升
6.某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化合价数值为---------------------------------------------------------------(C)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
〖提示:C是奇数价时的值,当其为偶数价时,此值为![]() 〗
〗
7.某Na2SO3样品已部分被氧化为Na2SO4,经测定该混和物中含硫25%,则混和物中Na2SO3与Na2SO4的物质的量之比为-------------------------------------(D)
A.7:6 B.6:7 C.1:7 D.7:1
〖提示〗:设![]() 的总量为1mol,部分被氧化后,剩余的
的总量为1mol,部分被氧化后,剩余的![]() 的量为(1-x)mol,生成
的量为(1-x)mol,生成![]() 的量为xmol,则有
的量为xmol,则有![]() ,解得x=
,解得x=![]() ,则可求得最后两者的物质的量之比为7:1。如果引题用十字交叉法求解也可以,但一定要注意得出的值可能是质量比,要将质量比换算成物质的量之比。
,则可求得最后两者的物质的量之比为7:1。如果引题用十字交叉法求解也可以,但一定要注意得出的值可能是质量比,要将质量比换算成物质的量之比。
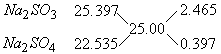
2.465:0.397=6.21:1(质量比)
![]() 与
与![]() 的物质的量之比=
的物质的量之比=![]() =7:1
=7:1
8.以下各种情况下不能产生硫化氢的是---------------------------------------(BD)
A.鸡蛋腐败 B.浓硫酸和硫化亚铁反应
C.硫化钠和稀硫酸反应 D.硫化铜投入稀盐酸中
9.下列反应中,不能产生黑色固体的是-----------------------------------------(CD)
A.铜在硫蒸气中燃烧 B.铁丝在氧气中燃烧
C.氯气与硫化氢气体混和 D.氯化锌溶液与硫化钠溶液混和
10.能在空气中稳定保存的物质是-----------------------------------------------(D)
A.亚硫酸 B.亚硫酸钠 C.硒化氢水溶液 D.硫黄
11.充分煅烧黄铁矿W克,反应后得到固体N克,生成SO2P克,假设杂质在煅烧过程中不参加反应,则黄铁矿的百分含量可表示为----------------------(BC)
A.![]() ×100% B.
×100% B.![]() ×100%
×100%
C.![]() ×100% D.
×100% D.![]() ×100%
×100%
〖提示〗:4![]() +11
+11![]() =2
=2![]() +8
+8![]() DW
DW
480 320 512 160
An P W-N
A可能出现三组值:A1=![]() A2=
A2=![]() A3=
A3=![]()
12.在常温常压下,将a升SO2和b升H2S混和,当反应后气体体积是反应前气体体积的![]() 时,则a与b之比是------------------------------------------------------(D)
时,则a与b之比是------------------------------------------------------(D)
①:1:1 ②1:2 ③1:3 ④2:1
A.① B.②③ C.③④ D.①③
〖提示〗:有两种情况,分别是SO2过量或H2S过量;当某种气体过量时,可设过量部分为![]()
13.工业上燃烧梳铁矿制取硫酸(按触法),若要生产1.6吨98%的浓硫酸需要标况下的空气(设空气中氧气占![]() )多少立方米?--------------------------------------(C)
)多少立方米?--------------------------------------(C)
A.2240m3 B.4480m3 C.3360m3 D.5600m3
〖提示〗:将各步反应合并后得到如下的关系式和关系量:
关系式 15O2 ~ 8H2SO4
关系量 15摩 8×98克
?=3×104摩 1.6×106×0.98克
空气的体积=3×104×22.4×5升
14.向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量--------------------------------------------------------------(
A )
A.小于0.45摩 B.等于0.45摩
C.在0.45摩与0.90摩之间 D.大于0.90摩
15.向三氯化铁和氯化钡的混和溶液中通入二氧化硫气体,有白色沉淀生成,此沉淀是----------------------------------------------------------( D )
A.硫化亚铁 B.硫磺 C.亚硫酸钡 D.硫酸钡
【提示】:2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+
16.在常温常压下,24毫升H2S和O2的混和气点火燃烧,生成6毫升SO2时,则原混和气体中H2S的体积为---------------------------------------------------(AB)
A.6毫升 B.12毫升 C.15毫升 D.18毫升
〖提示〗:C为常见错误—在H2S过量时,但实际上这种情况不存在,也就是说,在已知有SO2生成的情况下,不可能有H2S存在,因为这两者不能共存!
17.相同浓度、相同体积的稀硫酸与足量的下列物质反应,所得溶液的物质量 的浓度最大的是-----------------------------------------------------------------------------(A)
A.ZnS B.ZnO C.Zn(OH)2 D.ZnCO3
18.含FeS2A%的黄铁矿W吨,在用接触法硫酸的过程中,损失硫C%,可制得浓度为B%的硫酸为--------------------------------------------------------------------(A) A.![]() 吨 B.
吨 B.![]() 吨
吨
C.![]() 吨 D.
吨 D.![]() 吨
吨
19.石膏[CaSO4·2H2O]加热到150~170℃时,会失去部分结晶水而生成熟石膏[2CaSO4·H2O],则通过加热每生成1摩熟石膏失去水的物质的量为-----(D)
A.1摩 B.1.5摩 C.2摩 D.3摩
〖辨析〗:如果没有认识到熟石膏的化学式2CaSO4·H2O所表示的就是1摩物质,很有可能会错选B: “CaSO4·2H2O中2摩水- CaSO4·![]() H2O中的
H2O中的![]() 摩水=1.5摩水”。
摩水=1.5摩水”。
20.硫酸盐种类很多,有的在实际应用上很有价值,如作净水剂、媒染剂、防腐剂、X射线造影剂、缓泻剂、颜料等。同时具有上述三种或三种以上用途的是----------------------------------------------------------------------------------------------(B)
A.芒硝 B.皓矾 C.明矾 D.硫酸铁
21.在常温、常压下将a升SO2和b升H2S混和,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为---------------------------------------------(AC)
A.1:1 B.1:2 C.1:3 D.2:1
〖提示〗:当SO2过量时为A,当H2S过量时为C
22.含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,问生产98 %的硫酸1吨,需黄铁矿多少吨----------------------------------(A)
A.0.742 B.0.85 C.0.845 D.1
23.在氧气中燃烧0.4克硫和铁组成的化合物样品,使其中硫全部转化为SO2,又全部转化为硫酸,这些硫酸可以跟20毫升0.5摩/升的NaOH溶液完全中和,原化合物中硫的百分含量是-------------------------------------------------〖A〗 A.40% B.46% C.53% D.73%
24.已知在FeSO4和Fe2(SO4)3组成的混和物中,硫元素的质量百分含量为a%,则混和物中铁元素的质量百分含量为--------------------------------------〖C〗
A.(100-a)% B.(100-2a)% C.(100-3a)% D.(100-4a)%
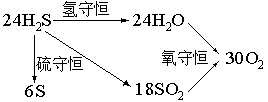
25.24毫升H2S在30毫升O2中燃烧,在同温同压下,得到的SO2的体积是〖D〗
A.24毫升 B.30毫升 C.20毫升 D.18毫升
【解一】:可采下直接配平法,写出下面的反应方程式:
24H2S+30O2
= 6S+18SO2+24H2O
【解二】:采用守恒法(其基本点与上解类似):
该题涉及到的两个反应分别是2H2S+3O2
= 2SO2+2H2O和2H2S+O2
= 2S+2H2O,从这两个反应式中可知:H2S中的氢元素全部转移到H2O中,S元素全部转移到SO2和单质S中,而O2中的氧元素全部转移到H2O和SO2中,
26.将绿矾晶体加热,除失去结晶水外,还发生下列反应
2FeSO4=Fe2O3+SO2↑+SO3↑
若将该反应的气体通入氯化钡溶液,则有-----------------------------------〖AD〗
A.硫酸钡沉淀 B.亚硫酸钡沉淀
C.SO3气体逸出 D.SO2气体逸出
27.下列哪些事实是由于氯的非氧化性比硫强的结果--------------〖BC〗
A.次氯酸的酸性比硫酸弱 B.氯能置换硫化氢中的硫
C.硫离子的还原性比氯离子强 D.硫能在空气中燃烧,而氯则不能
28.以下有关接触法制硫酸的论述错误的是----------------------〖D〗
A.为提高反应速度和原料利用率,硫铁矿要在“沸腾”状态下燃烧
B.为防止催化剂中毒,气体在进接触室前要先净化
C.接触室中热交换器其主要作用是预热末反应的气体和冷却反应后的气体
D.吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部出来放空
29.下列反应产生的气体,通过Na2SO3溶液而不反应的是------------〖B〗
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片
⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和稀硝酸
A.①② B.② C.①②⑤ D.全部反应
30.在氧气中灼烧0.44克硫和铁的化合物,使其中的硫全部转化成二氧化硫,把这些二氧化硫全部氧化并转化为硫酸,这些硫酸可以用20毫升0.5摩/升的NaOH溶液完全是和,则原化合物中硫的百分含量为-------------------------〖D〗
A.18% B.46% C.53% D.36%
31.现有1升含SO3为30%的发烟硫酸(密度为1.95克/毫升),要把它稀释为浓度为95%的硫酸,需加入水的体积约为---------------------------------------〖C〗
A.120毫升 B.180毫升 C.241毫升 D.300毫升
〖提示〗:含SO3为30%,说明在100克溶液中含有游离的SO330克;加入的水先与SO3反应生成H2SO4,再将H2SO4稀释。
32.用浓硫酸吸收SO3可得到H2SO4·SO3,若用1.00克98%的硫酸溶液充分吸收SO3后,再进行稀释,可得到98%的硫酸质量为--------------------〖C〗
A.1.98克 B.2.00克 C.2.22克 D.2.42克
〖提示〗:很有可能会错选B,错选的原因是只看到1.00克98%硫酸中含有溶质的量为0.01mol,等量吸收![]() 后,共生成硫酸0.02mol ,而没有考虑到在通入
后,共生成硫酸0.02mol ,而没有考虑到在通入![]() 的过程中,
的过程中,![]() 先与2%的水反应生成硫酸,然后再吸收
先与2%的水反应生成硫酸,然后再吸收![]() 成H2SO4·SO3
成H2SO4·SO3
32.下列不能用浓硫酸来干燥的气体是--------------------------------------〖BD〗
A.HCl B.HI C.SO2 D.NH3
33.跟100毫升 0.1摩/升(NH4)2SO4溶液中的NH4+浓度相同的是-----〖BC〗
A.0.1摩/升 NH4NO3溶液100毫升
B.0.2摩/升NH4NO3溶液100毫升
C.0.2摩/升 NH4Cl溶液200毫升
D.0.2摩/升 (NH4)2SO4
溶液50毫升
34.
35.
36.
37.
填 空 题
1.如果黄铜矿的成分是CuFeS2和少量的SiO2。已知S的质量百分含量为a%,则铜的质量百分含量为【答:a%】;如用此矿石1吨制硫酸,矿石利用率为98%,SO2的转化率为96%,则可制得98%的硫酸【答:0.0249a】吨
2.今有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同族元素,B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶于二硫化碳,则这四种元素分别是A【答:氢】、B【答:氧】、C【答:钠】、D【答:硫】
〖提示:A、C也可以分别是氦、氩〗
3.供选择的答案:①在水溶液中电离,并呈强酸性 ②具有高沸点、难挥发性 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性
在下列变化中,硫酸体现的性质为:
(1)铜跟浓硫酸共热,产生二氧化硫气体【答: ①⑤】
(2)亚硫酸钠中加入硫酸,产生二氧化硫气体【答:①②】
(3)氯化钠固体跟浓硫酸的混和物共热时产生氯化氢气体【答:②】
(4)浓硫酸能用来干燥H2、O2、Cl2等,但不能用来干燥NH3、HI等【答:①③⑤】
(5)纸张、布片、蔗糖等遇浓硫酸会慢慢变黑【答:④】
(6)浓硫酸跟氨水反应完全后,溶液的PH值小于7【答:①】
(7)蔗糖溶液中加入少量硫酸后微热,生成葡萄糖和果糖【答:①】
(8)浓硫酸与溴化钠的混和物加热时产生混和气体【答:②⑤】
(9)浓硫酸跟灼热的炭反应时产生混和气体【答:⑤】
4.某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A、B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:
Cl2+Na2SO3+H2O
== Na2SO4+2HCl
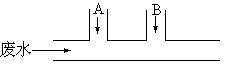
试写出:
(1)A、B处应加入的物质的化学式依次为【答:Na2SO3】和【答:NaOH】
(2) A、B处发生的反应的离子方程式是:
A【答:Cl2+SO32-+H2O
== SO42-+2H++2Cl-】
B【答:H++OH-
== H2O】
5.某热电厂地处多雨地带,使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,试解释出现这种现象的原因。
【答:煤燃烧后,硫转化成二氧化硫气体,形成酸雨使何水酸度增大,排出的热水又使河水的温度升高,O2的溶解度降低,鱼类在这种环境中无法生存而绝迹】
6.工业上制取CuSO4不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡,试分析这种制备办法的优点。
〖提示:这种办法的优点主要有两处:一是不产生污染空气的二氧化硫,二是提高了硫酸的利用率〗
7.为降低硫的氧化物对空气的污染,可把氧化钙和含硫的煤混和后燃烧,这种方法叫做钙基固硫,试写出有关的化学方程式
【答:S+O2
== SO2 2CaO+2SO2+O2
== 2CaSO4】
8.在2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O反应中,【答:FeS】是还原剂,氧化产物和还原产物的质量比为【答:29:12】。
Fe2(SO4)3+3SO2↑+2S↓+6H2O反应中,【答:FeS】是还原剂,氧化产物和还原产物的质量比为【答:29:12】。
〖提示〗:Fe2(SO4)3也是氧化产物
9.将等物质的量的Cl2和SO2气体通入滴有石蕊试液的BaCl2溶液中,出现的现象是【答:产生白色沉淀,试液变成红色】。
10.把1克含脉石(SiO2)的黄铁矿样品在空气中灼烧,反应后得残渣0.78克,此黄铁矿的纯度是【答:66%】。
〖提示〗:2FeS2 ~ Fe2O3 DW
240
160 80
?=0.66
0.22
11.某氧化剂中,起氧化作用的是X2O72-,在溶液中0.2 mol的该离子恰好能使0.6mol的SO32-完全氧化,则X2O72-被还原后元素X的化合价为【答:+3】 。
12.某亚硫酸钠已部分被氧化成硫酸钠,经测定该混和物含硫25%,则混和物中亚硫酸钠与硫酸钠的物质的量之比为【答:7:1】
13.在FeSO4、Fe2(SO4)3、BaSO4、Al2(SO4)3的混和物中,氧元素含量的质量百分比为a%,试求含硫元素的质量百分比及Fe,Ba,Al三元素质量的总和占混和物质量的百分比.【答: 0.5a%、1-1.5a%】
14.有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1:1组成的化合物,其他元素形成的单质(仍用a、b、c表示)和组成的化合物之间的反应关系如下(未配平)
Ⅰ、b + c→Y Ⅱ、a+c→Z Ⅲ、X+Y→m Ⅳ、X+Z→c+n Ⅴ、Y+Z→c+n
(1)上述反应中,最有充分理由说明该反应一定属于氧化还原反应的
是 ▲ (填反应编号)。
【答:Ⅰ、Ⅱ、Ⅳ、Ⅴ】
(2) 如果m是一种无色粘稠油状液体化合物,则X、Y、Z的化学式分别是 ▲ 、 ▲ 、 ▲ 。
【答:![]()
![]()
![]() 】
】
(3)Ⅲ步反应的化学方程式是 ▲ 。
【答:![]() +
+![]() =
=![]() 】
】
(4)Ⅳ步反应的化学方程式是
▲ 。
【答:![]() +
+![]() =S¯+2
=S¯+2![]() 】
】
15.
计 算 题
1.m克铁粉和n克硫粉混和共热后(不考虑Fe与O2)的反应,将反应混和物溶于足量的稀盐酸中,则标况下可产生气体【答:![]() ×22.4升】
×22.4升】
2.取50毫升Na2CO3 和Na2SO4 的混和溶液,加入过量氯化钡溶液后得到 14.51克白色沉淀,用过稀硝酸处理后沉淀减少到4.66克,并有气体放出.试计算:
⑴原混和溶液中Na2CO3 和Na2SO4 的物质的量的浓度
⑵产生的气体在标准状况下的体积
【解】:⑴14.51克白色沉淀是BaCO3 和BaSO4 的混和物
Na2SO4
的物质的量=BaSO4
的物质的量=![]() =0.02 摩
=0.02 摩
所以Na2SO4 的物质的量的浓度=0.02/0.05=0.40 摩/升
Na2CO3 的质量=14.51-4.66=9.85克
Na2CO3
的物质的量=![]() =0.05 摩
=0.05 摩
Na2CO3的物质的量的浓度为=![]() =1 摩/升
=1 摩/升
⑵设生成的气体在标准状况下的体积为x升
BaCO3+2HNO3 =Ba(NO3)2+H2O+CO2 ↑
1 摩 22.4 升
0.05 摩 x x=1.12 升
3.常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如下图的转变关系,试回答:
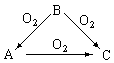
(1)A是【答:S】B是【答:H2S】C是【答:SO2】
(2)B的物质的量为x,氧气的物质的量为y,则当B跟氧气恰好反应,完全转化为A时, x与y 的数值关系为【答:y=![]() 】;若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是【答:
】;若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是【答: ![]() <y£
<y£![]() 】
】
〖提示〗:可采用直接配平法
4.在标准状况下,将100毫升H2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
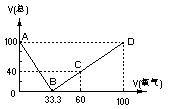
(1)写出图中B、C两点处的化学反应方程式
【答】:B点的反应:2H2S+O2
== 2S+2H2O
C点的反应:2H2S+3O2
== 2SO2+2H2O
(2)通过对图像的分析得出:
①当V总>40毫升、②V总<40毫升、③V总=40毫升时气体的成分
【答】:
| AB段 | BD段 | |
| ①V总>40毫升 | H2S | O2与SO2 |
| ②V总<40毫升 | H2S或没有 | SO2或没有 |
| ③V总=40毫升 | H2S | SO2 |
(3) 当V总=25毫升时,求原混合气体中H2S和O2的体积各多少毫升?
【答】:当V总=25毫升时,从图中可以看出,在AB段与BD段均有可能。
(1)当在AB段时,H2S过量,反应后剩余的气体就是过量的H2S。设原混和物中O2的体积为x毫升、H2S的体积为2x+y毫升(y毫升就是过量的H2S的体积),由题给条件可列出以下两式:
x+2x+y=100----------① ![]() (或直接写出x=25)-----②
(或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75毫升,O2的体积为25毫升。
(2)当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
==![]() S+
S+![]() SO2+xH2O
SO2+xH2O
其中x+y=100,所以![]() =0.25,解得:x=y=50毫升
=0.25,解得:x=y=50毫升
所以原混和气体中两种气体的体积均为50毫升。
5.由含FeS2m%的黄铁矿w吨制取硫酸,假设在制硫酸的三个反应过程中硫元素的利用率分别为a%、b%、c%,问最终可制得98%的硫酸多少吨?
【答】:可制得98%的硫酸![]()
6..200吨含FeS2为75%的黄铁矿,煅烧损失10%的FeS2,SO2转化为SO3时的转化率为96%,SO3的吸收率为95%,可生产98%的硫酸多少吨?
〖提示〗:FeS2 ~ 2H2SO4
120 196
200×0.75×0.9×0.96×0.95 0.98x
解之得: x=205.2吨
7.有一混和物由硫化钠、亚硫酸钠和硫酸钠组成,经测定含硫25.6%,求该混和物中氧元素的质量分数。【答:37.6%】
〖提示〗:由这三种盐的化学式可以看出它们的分子式中都有“Na2S”这个组合,因此,这种混和物可以看作是“Na2S”与“O”所组成的混和物:
Na2S ~ S
78 32
?=62.4% 25.6%
所以混和物中氧元素的质量分数=1-62.4%=37.6%
8.在常温常压下,100毫升H2S与O2的混和气体在一定条件下完全反应,恢复到原状态时,最后得到气体25毫升,试求最后得到的气体是什么?原混和气体中两种气体各占多少毫升?
〖提示〗:当硫化氢过量时,硫化氢与氧气的体积分别是75毫升和25毫升;当最后得到的气体是二氧化硫时,两种气体的体积都是50毫升(此时可用直接配平法求出)
9.含有FeS2 65%的硫铁矿在煅烧的时候,有1.8%的硫受到损失而混入炉渣,由这种硫铁矿2吨可以制得98%硫酸多少吨?
【解】设可以制得此硫酸x 吨。
FeS2 ~ 2H2SO4
120 98×2
2×65%×(1-1.8%) x×98%
120:196=2×65%×(1-1.8%):(x×98%)
\x=2.13(吨)
答:~。
10.有一长期放置的亚硫酸钠固体,其中已有一部分被氧化成为硫酸钠,经定量分析已知含硫的质量分数为25%,求该样品中亚硫酸钠的质量分数和氧化率及钠、氧的质量分数。
【解】:设该样品中的Na2SO3为x克、Na2SO4为y克,得:
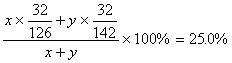 ,解得
,解得![]()
当Na2SO3为63×7m=441m克时,Na2SO4为71m克,混和物中Na2SO3的质量分数=![]()
被氧化的Na2SO3=![]()
氧化率=![]()
钠的质量分数=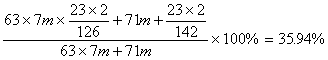
氧的质量分数为39.06%
〖说明:如果利用混和物中钠元素:硫元素的质量比恒等于23:16,则计算过程还可简化〗
11.