高三化学试卷 (1)
可能用到的原子量:
H 1 He 4 C 12 N 14 O 16 Na 23
Mg 24 Al 27 S 32 Cl 35.5 Zn 65
一. 选择题:
请分析比较题中所列前后两元素的化学参数的关系前后2个值的大小。
用(A)、(B)、(C)、(D)表示前者和后者的关系。
1. Na 的离子半径和Ne 的原子半径( )
(A) 大于 (B) 小于
(C) 等于 (D) 不能肯定
2. Ge 和Sn 的熔点( )
(A) 大于 (B) 小于
(C) 等于 (D) 不能肯定
3. ![]() 和
和 ![]() 的中子数( )
的中子数( )
(A) 大于 (B) 小于
(C) 等于 (D) 不能肯定
4. 已知Pb 的原子序数为82 ,再发现与Pb 同一主族的元素R ,它的原子序数应为( )
(A) 90 (B) 100
(C) 114 (D) 132
5. 下列哪种物质既可与Na2CO3 反应,又可与NaHCO3 反应( )
(A) CH3COONa (B) 石炭酸
(C) NaOH (D) H2O
6. 下列溶液,在空气中既易被氧化,本身又易分解的是( )
(A) 苯酚 (B) H2SO3
(C) NaHCO3 (D) HNO3 (浓)
7. 在标准状况下,向体积为V升的容器中放入a摩CS2 和b摩O2 ,待燃烧后恢复到开始时
的温度和压强条件时,容器中气体的体积为( )
(A) a摩 (B) b摩
(C) (3a-b)摩 (D) (a+b)摩
8. 在相同温度、压强条件下,将同体积的CO2 分别通入下列溶液中,能得到 ![]() 浓度
浓度
最大的是( )
(A) 过量氨水溶液
(B) 过量饱和Na2CO3 溶液
(C) 过量CH3COOH 溶液
(D) 过量蒸馏水
9. 下列说法正确的是 ( ) ( N![]() 表示阿伏加德罗常数值 )
表示阿伏加德罗常数值 )
① 11.2升氨气所含有的分子数一定是0.5 N![]()
② 在常压、室温条件下,1摩氩气含有的原子数为N![]()
③ 48克臭氧所含有的原子数为3N![]()
④ 在同温同压时,相同体积的任何气体单质所含有的原子数目相同
(A) ①、② (B) ②、③
(C) ①、②、③ (D) ②、③、④
10. 下列离子方程式不正确的是( )
① 氢氧化铜的悬浊液与盐酸反应: OH![]() + H
+ H![]() = H
= H![]() O
O
② 氯化铝溶液与过量氨水反应: Al![]() + 3NH
+ 3NH![]() ·H
·H![]() O = Al(OH)
O = Al(OH)![]() ↓ + 3NH
↓ + 3NH![]()
③ 小苏打溶液与饱和石灰水反应: HCO![]() + Ca
+ Ca![]() + OH
+ OH![]() = CaCO
= CaCO![]() ↓ + H
↓ + H![]() O
O
④ 苯酚钠溶液中通入过量的CO![]() :C6H5O
:C6H5O![]() + H
+ H![]() O + CO
O + CO![]() = C6H5OH↓+ HCO
= C6H5OH↓+ HCO![]()
(A) ①、② (B) ①、③
(C) ②、③ (D) ①、④
11. 在pH=3的溶液中,可以大量共存的是( )
(A) K![]() Na
Na![]() Br
Br![]() S
S![]()
(B) Al![]() Ca
Ca![]() NO
NO![]() Cl
Cl![]()
(C) Na![]() K
K![]() AlO
AlO![]() NO
NO![]()
(D) K![]() Na
Na![]() SO
SO![]()
![]()
12. 100毫升0.1摩/升氨水与50毫升0.1摩/升稀盐酸溶液混和,在所得溶液中( )
(A) [Cl![]() ]>[NH
]>[NH![]() ]>[H
]>[H![]() ]>[OH
]>[OH![]() ]
]
(B) [NH![]() ]>[Cl
]>[Cl![]() ]>[OH
]>[OH![]() ]>[H
]>[H![]() ]
]
(C) [Cl![]() ]>[NH
]>[NH![]() ]>[OH
]>[OH![]() ]=[H
]=[H![]() ]
]
(D) [Cl![]() ]=[NH
]=[NH![]() ]>[H
]>[H![]() ]>[OH
]>[OH![]() ]
]
13. 100毫升12 摩/升盐酸溶液与过量锌粉反应,在一定温度下,为了减慢反应进行的速度,
但又不影响生成氢气的总量,可向反应物中加入适量的( )
① 碳酸钙粉末 ② 氯化钠溶液 ③ 氯化铵(固体) ④ 水
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
14. 在氨水的下列性质中,可以证明它是弱电解质的是( )
① 1摩/ 升氨水溶液的pH值约为11.6
② 浓氨水可与水以任何比例互溶
③ 20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④ 在相同条件下,氨水的导电性比盐酸弱
(A) ①、② (B) ①、④
(C) ①、③ (D) ②、④
15. 下列物质能跟镁粉反应,并有氢气放出的是( )
① 醋酸溶液 ② 福尔马林
③ 葡萄糖粉末共热 ④ 乙醚
(A) ①、② (B) ①、④
(C) ①、③ (D) ②、④
16. 在下列溶液中,分别加入少量的二氧化锰粉末,可能发生反应的是( )
(A) KI 溶液 (B) 酸性 KI 溶液
(C) KOH 溶液 (D) K2CO3 溶液
17. 相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀
物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为( )
(A) 1 :2 :3 (B) 3 :2 :1
(C) 6 :3 :1 (D) 6 :3 :2
18. 在一定条件下,可逆反应A(气)+B(气)→2C(气) 达到平衡的标志是( )
① A 、B 、C 的分子数比为1 :1 :2
② A 、B 、C 的浓度不再发生变化
③ 单位时间生成n 摩尔A ,同时增加2n 摩尔C
④ 平衡体系中的压强不再发生变化
(A) ①、② (B) ①、④
(C) ②、③ (D) ②、④
19. 反应4NH3+3O2→2N2+6H2O在5升的密闭容器中进行,半分钟后,N2的物质的量增加了0.6
摩,则此反应的平均速度v![]() (表示反应物的消耗速度或生成物的生成速度)为(
)
(表示反应物的消耗速度或生成物的生成速度)为(
)
① VO![]() = 0.72 摩/(升·分) ② VN
= 0.72 摩/(升·分) ② VN![]() = 0.12 摩/(升·分)
= 0.12 摩/(升·分)
③ VH![]() O = 0.72 摩/(升·分) ④ VNH
O = 0.72 摩/(升·分) ④ VNH![]() = 0.008 摩/(升·秒)
= 0.008 摩/(升·秒)
(A) ①、② (B) ②、④
(C) ②、③ (D) ③、④
20. 对苯乙烯( C6H5CH=CH2 )的下列说法属正确的是( )
(A) 是乙烯的同系物 (B) 是苯的同系物
(C) 属于脂肪烃 (D) 属于芳香烃
21. A1 和A2 是两种一元酸,它们的摩尔浓度c1 < c2,电离度a1 < a2,
溶液的pH值pH1 <pH2,则两种酸( )
(A) 都是强酸 (B) 都是弱酸
(C) a1 是强酸,a2 是弱酸 (D) a1 是弱酸,a2 是强酸
22. 下列各组溶液,不用其它试剂就不能将它们区别开的是( )
(A) 石灰水和碳酸钠 (B) 偏铝酸钠和盐酸
(C) 石灰水和磷酸 (D) 硫酸铝和氢氧化钠
23. 30毫升浓度为0.05 摩/ 升的Na2SO3 溶液,恰好与50毫升浓度为0.02 摩/升的KMnO4 溶
液完全反应,则元素Mn 在被还原的产物中的化合价是( )
(A) +2 (B) +4
(C) +6 (D) +7
24. 在反应 2X + 5Y = 4R + 2M 中,已知R 和M 的摩尔质量之比为22 :9 ,当 2.6 克X 与
Y 完全反应,生成4.4克R ,则在此反应中Y 和M 的质量比为( )
(A) 26 :9 (B) 39 :9
(C) 40 :9 (D) 53 :9
25. 常温下,向20升真空容器内通入a 摩硫化氢和b 摩二氧化硫,反应完全后,容器内气
体密度最大时的硫化氢与二氧化硫的物质的量的比是( )
(A) 2 :1 (B) 1 :2
(C) 2 :3 (D) 3 :2
26. 某温度下,在100克水中加入m 克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达
到饱和,则m和n的关系应符合( )
(A)
![]() (B)
(B) ![]()
(C)
![]() (D)
(D) ![]()
二、分析题和实验题:
|
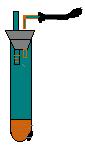
1. 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处: |
(1). 波形试管中左液面( ),右液面( ).
(A) 下降,上升。 (B) 上升,下降。
(C) 下降,不变。 (D) 不变,下降。
( )
(2). 试管中液体分为两层,上层呈( )色, 下层呈( )色。
(A) 上层蓝色,下层红色。 (B) 上层红色,下层无色。
(C) 上层蓝色,下层无色。 (D) 上层无色,下层蓝色。
( )
(3). 若在下层溶液中有白色固体沉降出来,则发生反应的化学方程式为:
CuSO4·5H2O
![]()
请判断:( )
(4). 若在下层溶液中有蓝色晶体析出,则此蓝色晶体的分子式为:
![]() .
.
请判断:( )
2. 实验室制备溴苯的主要步骤如下:
①、在烧瓶中加入4毫升苯和1毫升液溴,并加入少量无锈铁屑。
②、将反应仪器迅速组装好,不需加热,很快发生反应,似沸腾状。
③、将所得产品依次用蒸馏水和5% NaOH 溶液洗涤,再用蒸馏水洗涤便可得到粗溴苯。
(1) 应注意的是:要用(干燥 ) 的烧瓶加入铁屑是起( 催化 )作用。
请判断:( )
(2) 烧瓶口上的导管很长,它是起______的作用。( )
(A)导气、冷凝。 (B)冷凝、回流。
(C)导气、回流。 (D)导气、冷凝、回流。
(3) 用5%的 NaOH 溶液洗涤产品的作用是( 除去溴苯中溶解溴)
请判断:( )
发生反应的化学方程式为:2NaOH + Br![]() = NaBr + NaBrO + H
= NaBr + NaBrO + H![]() O
O
请判断:( )
(4) 纯溴苯是___色,密度比水___,状态为___状___体。( )
(A)粉红色,大,油状,液体。
(B)无色,大,油状,挥发性液体。
(C)无色,大,油状,液体。
(D)无色,大,油状,固体。
3. 在冶金工业的烟道废气中,常混有大量的SO2和CO ,它们都是大气的污染物,在773 K
和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫磺。
请写出该反应的化学方程式:SO![]() + 2CO = 2CO
+ 2CO = 2CO![]() + S .
+ S .
请判断:( )
|
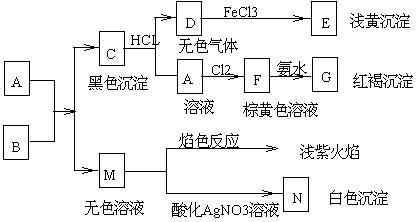
4. A、B 两种化合物的溶液按下列图示完成实验: |
(1) 两化合物的化学式A、B分别是:( )
(A) FeCl![]() ,SO
,SO![]() .
(B)FeCl
.
(B)FeCl![]() , K
, K![]() S
S
(C) FeCl![]() , K
, K![]() S (D)
Fe
S (D)
Fe![]() O
O![]() , K
, K![]() S
S
(2) 写出离子方程式:
C→D :
FeS + 2H![]() = Fe
= Fe![]() + H
+ H![]() S↑
S↑
请判断:( )
(3) 写出离子方程式:D→E :__________________________. ( )
(A) 2Fe![]() + H_2_S = 2Fe
+ H_2_S = 2Fe![]() + S↓+2H
+ S↓+2H![]()
(B) FeS + 2H![]() = Fe
= Fe![]() + H2S↑
+ H2S↑
(C) 2Fe![]() + Cl2 = 2Fe
+ Cl2 = 2Fe![]() + 2ClH
+ 2ClH![]()
(D) Fe![]() + 3NH3·H2O =
Fe(OH)3↓ + 3NH
+ 3NH3·H2O =
Fe(OH)3↓ + 3NH![]()
(4) 写出离子方程式: A→F _______________________.( )
(A) 2Fe![]() + H2S = 2Fe
+ H2S = 2Fe![]() + S↓+2H
+ S↓+2H![]()
(B) FeS + 2H![]() = Fe
= Fe![]() + H2S↑
+ H2S↑
(C) 2Fe![]() + Cl2 = 2Fe
+ Cl2 = 2Fe![]() + 2Cl
+ 2Cl![]()
(D) Fe![]() + 3NH3 H2O = Fe(OH)3↓ +
3NH
+ 3NH3 H2O = Fe(OH)3↓ +
3NH![]()
(5) 写出离子方程式:F→G :_____________________________.
Fe![]() + 3NH
+ 3NH![]() ·H
·H![]() O = Fe(OH)
O = Fe(OH)![]() ↓ + 3NH
↓ + 3NH![]()
请判断:( )
5. A、B、C是由周期表中短周期元素间组成的三种化合物,它们各由两种元素组成,甲、
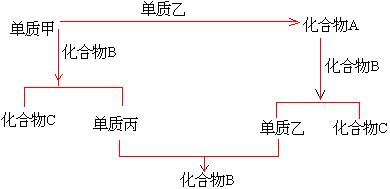 |
乙、丙是三种单质,这些单质和化合物之间存在如下关系。
(1). 据此判断:单质甲必定是( )
( 填 1---“金属” 或 2---“非金属” ).
(2). 据此判断:单质乙的分子式可能是( ).
(A)O![]() (B)Na
(B)Na![]() O
O![]()
(C)H![]() O
(D)NaOH
O
(D)NaOH
(3). 据此判断:化合物A、B、C的分子式分别是( ).
(1) O![]() (2) Na
(2) Na![]() O
O![]() (3) H
(3) H![]() O (4) NaOH
O (4) NaOH
(A) (1) (2) (4) (B) (2) (4) (3)
(C) (2) (3) (4) (D) (3) (1) (2)
三、问答题
1. CH![]() COOH是一种弱酸,而氯乙酸(CH
COOH是一种弱酸,而氯乙酸(CH![]() CLCOOH)的酸性强于CH
CLCOOH)的酸性强于CH![]() COOH,这是因为—CL是一种强吸引电子基团,能使—OH上的H 原子具有更大的活动性。有的基团属于斥电子基团,能减弱—OH上H 原子的活动性,这种作用叫“诱导效应”。
COOH,这是因为—CL是一种强吸引电子基团,能使—OH上的H 原子具有更大的活动性。有的基团属于斥电子基团,能减弱—OH上H 原子的活动性,这种作用叫“诱导效应”。
根据以上规律判断:
(1). HCOOH 显酸性,而H![]() O 呈中性,这是由于HCOOH分子中存在____电子基团,
O 呈中性,这是由于HCOOH分子中存在____电子基团,
这种基团是_________。( )
(A) 吸,羟基 (B) 吸,羧基
(C) 斥,羧基 (D) 斥,羟基
(2). CH![]() COOH 的酸性弱于HCOOH,这是由于CH
COOH 的酸性弱于HCOOH,这是由于CH![]() COOH 分子中存在(斥)电子基团,
COOH 分子中存在(斥)电子基团,
这种基团是(甲基)。
请判断:( )
(3). ![]() (苯基)也属于吸电子基团,所以
(苯基)也属于吸电子基团,所以![]() (苯甲酸)酸性比乙酸的酸性
(苯甲酸)酸性比乙酸的酸性
( )。
(填 1---“强”或 2---“弱”)。
2. 根据以下反应事实:
(1) 甲苯可使酸性KM![]() O4 溶液褪色,其反应是C6H5CH3
被氧化为C6H5COOH;
O4 溶液褪色,其反应是C6H5CH3
被氧化为C6H5COOH;
(2) CH3COONa + NaOH ![]() Na2CO3
+ CH4↑
Na2CO3
+ CH4↑
请写出甲苯制成苯的各步反应式。
〖解答〗
3. 虽然有机化合物A、B的分子式不同,但它们所含元素只可能是碳、氢、氧中的两种或三种。如果将A、B以任何一种比例混合,只要其物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变,则A、B组成必须满足的条件_______________________。
〖解答〗
4. 取50.0毫升Na2CO3 和Na2S 的混和溶液,加入过量的AgNO3 溶液后,得到3.86克
沉淀;用过量的稀醋酸处理后,沉淀量减少到2.48克,并有气体放出。
请计算:
(1) 原混和溶液中Na2CO3 的摩尔浓度是( )摩/升.
Na2S 的摩尔浓度是( )摩/升。
〖解答〗:
(2) 产生的气体在标准状态下的体积。( )升。
〖解答〗:
5. 已知某混和气体的体积百分组成中有80.0%的CH4、15.0%C2H2、5.0%的C2H4,
请计算0.5摩尔该混和气体的质量和在标准状态下的密度(克/升)。
〖解答〗:
6. CH4在一定条件下经催化氧化可以生成C2EH2 和C2H4,现取一定量的CH4,经上述催化氧化后得到混和气体,它在标准状况下的密度为0.7698克/升。已知反应中CH4消耗了20%,计算混和气体中C2H2的体积百分含量(保留三位有效数字)。
〖解答〗:
参 考 答 案
一. 1. B 2. A 3. B 4. C 5. B 6. B 7. B
8. B 9. B 10. D 11. B 12. B 13. D 14. B
15. C 16. B 17. D 18. C 19. D 20. D 21. B
22. A 23. B 24. C 25. A 26. B
二、1.
(1). A
(2). C
(3). 对
(4). 错
〖分析〗: 蓝色晶体是 ![]() ·
·![]() .
.
2.
(1) 对
(2) D
(3) 对;对
(4) C
3. 对
4.
(1) B
(2) 对
(3) A
(4) C
(5) 对
5.
(1). 1
〖解答〗
其理由是因为在短期周期元素的气体单质中,只有H![]() 、O
、O![]() 、N
、N![]() 、Cl
、Cl![]() ,其中氢气
,其中氢气
和氧气符合要求,甲只能是金属时才能与化合物B(H![]() O)反应,产生氢气。
O)反应,产生氢气。
(2). A (3). C
三、问答题
1.
(1). B
(2). 对
(3). 1
2.
〖解答〗
5C6EH5-CH2 + 6KMnO4 + 9H2SO4 → 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O.
C6H5-COOH + NaOH = C6H5COONa + H2O
C6H5COONa + NaOH → C6H6 + Na2CO3.
3.
〖解答〗
A、B 的分子式中氢原子的数目相同,且相差N个碳原子,
同时相差2N个氧原子。
4. (1)( 0.1 ) ( $W*0.2$ )
〖解答〗:
3.86 克沉淀是Ag2CO3和Ag2S 的混和物。
Na2CO3 的浓度 = ![]() (摩/升)
(摩/升)
Na2S 的浓度 = ![]() (摩/升)
(摩/升)
(2) ( 0.112 ) 升。
〖解答〗:
设生成的气体在标准状况下的体积为X升,
Ag2CO3 + 2CH3COOH = 2CH3COOAg + H2O + CO2↑
1摩 22.4 升
![]() X
升
X
升
解得,X = 0.112 升。
5. 〖解答〗:
0.5×(16×0.8+26×0.15+28×0.05 )= 9.05 (克)
混和气体的密度![]() = (克/升)
= (克/升)
6.〖解答〗:
设反应前CH4为1摩尔,其中有X 摩尔转化为C2H2,即生成![]() 摩尔的C2H2 和
摩尔的C2H2 和![]()
摩的C2H4。反应后混合气体总摩尔数为 = 0.8 + 0.1 = 0.9 (摩)
![]() (克/升)
(克/升)
解得 X = 0.081
C2H2 的百分含量为 4.5%.